カロテノイド:構造と機能から見る新たな視点
1. はじめに
カロテノイドは、自然界に広く分布する天然色素であり、植物や微生物において重要な機能を果たしている。本稿では、カロテノイドの生理活性とその役割について解説し、研究の重要性を考察する。カロテノイドは750種類以上が知られており[1, 2]、光合成を行う生物によって年間1億トン以上が生産されている。この膨大な生産量は、カロテノイドが地球上の生態系において極めて豊富に存在することを示している。これらの色素分子は、主に植物や藻類、光合成細菌などの生物によって合成され、環境中に広く分布している。一方で、動物はカロテノイドを合成する能力を持たない。そのため、動物は植物を摂取することでカロテノイドを取り込み、それを代謝することで生理活性を得ている[1, 2]。したがって、カロテノイドの研究を進める上で、その起源である光合成生物における存在意義と機能の理解は不可欠である。
- 図1
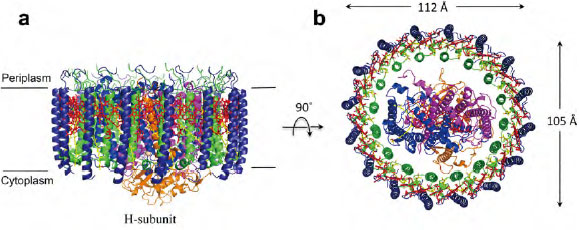
- Rsp. rubrum S1 株のLH1-RC 複合体構造の概要。(a)膜面と平行なLH1-RCの側面図。(b)膜のペリプラズム側から見たLH1-RCの上面図。色のスキームは次の通り。LH1-α:緑、LH1-β:群青、L-サブユニット:マゼンタ、M-サブユニット:青、LH1 およびスペシャルペアの Bchl α:赤いスティック、スピリロキサンチン:黄色のスティック。見やすくするために、リン脂質と界面活性剤は省略した。Tani, K. et al. Biochemistry 60, 2483-2491(2021)のFigure 1 より抜粋。
本稿では特に、カロテノイドの光捕集アンテナ作用について詳しく述べる。図1に示すのは、紅色光合成細菌の光捕集色素タンパク質複合体の構造である[3]。紅色光合成細菌における光捕集システムは、光合成の中でも特によく理解されている例の一つであり、多くの研究がこのシステムの解明のために行われてきた[4-6]。その主な目的は、光を捕集し、エネルギーを伝達するメカニズムを明らかにすることである。この光合成の光捕集系に関する研究は、効率的で堅牢な光捕集システムを構築するための貴重な情報を提供する可能性がある。例えば、近年注目されている人工光合成の分野においても、光エネルギーの効率的な捕集が大きな課題となっており、ここで得られた知見が活用される可能性がある。紅色光合成細菌には、LH(Light Harvesting)色素タンパク質複合体が二種類存在する。LH1(コアアンテナ複合体)はリアクションセンター(RC)を取り囲み、光エネルギーを伝達する役割を担っている。また、LH2(周辺アンテナ複合体)はLH1-RC複合体の周囲に存在し、太陽光エネルギーを効率的に吸収し、LH1に伝達する役割を果たしている。近年、クライオ電子顕微鏡(Cryo-EM)を用いた研究により、紅色光合成細菌の一種で本稿の主要課題であるRhodospirillum (Rsp.) rubrum S1株由来のLH1-RC複合体の詳細な分子構造が明らかになった[3]。この複合体は、16個の等間隔に配置されたα-βポリペプチドサブユニットから構成され、非常に美しいリング状の構造を形成している。さらに、この構造には光を吸収する色素として、カロテノイド(スピリロキサンチン)とバクテリオクロロフィル(Bchl α)が配置されている。
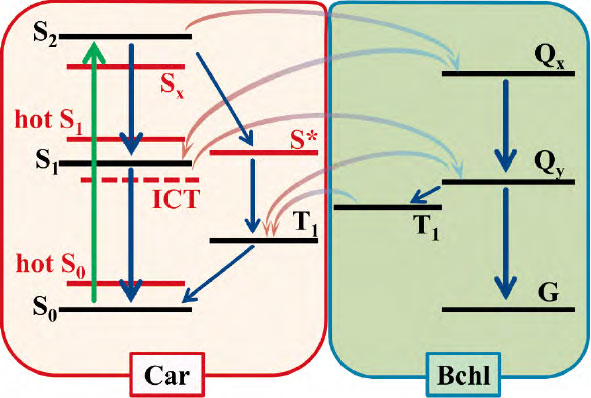
光合成細菌における光合成系では、カロテノイドからBchl α への励起エネルギー伝達(EET)が、光合成プロセス全体の効率を決定する重要な要素となる。図2は、光合成の初期過程において、カロテノイドからBchl α へのEETの経路を示している。長年の研究によって、カロテノイドの電子構造が詳細に解析されており、カロテノイドが光合成の初期過程において光捕集機能と光保護機能の両方を果たすことが明らかになっている[4-7]。カロテノイド分子は、可視光の青~緑の波長領域の光を吸収すると、基底状態から第二励起一重項(S2)状態へ遷移し、その後、第一励起一重項(S1)状態へと速やかに緩和する。カロテノイドからBchl α へのEETは、S2 状態およびS1 状態の両方から生じることが知られており、この巧妙な励起エネルギー伝達機構によって光エネルギーが効率的に利用される。一方で、光合成系に過剰な光エネルギーが照射されると、Bchl α が一重項励起(S1)状態から三重項励起(T1)状態へと遷移する。このBchl α T1 が酸素と反応すると、活性酸素が発生し、生体に損傷を与える可能性がある。そこで、カロテノイドは三重項エネルギーを受け取り、熱として散逸させることで活性酸素の発生を防ぎ、光損傷を抑制する。このように、カロテノイドは光捕集と光保護の両機能を担う極めて重要な分子である[8]。
- 図2
- 光合成の初期過程における、カロテノイドからBchl αへのEETの経路。カロテノイド励起後(緑の矢印)、考えられる無輻射過程の緩和経路を示している。紺色の矢印は内部転換・振動緩和・項間交差を、色が変化している山なりの矢印は、CarとBchl間のエネルギー移動を示している。
2.カロテノイドの基本構造と光機能
カロテノイドは主にポリイソプレンユニットが連結した炭化水素鎖を持ち、共役二重結合系が特徴である。この共役二重結合系が、カロテノイドの光吸収特性や抗酸化機能に大きく寄与する。さらに、カロテノイドは炭化水素型(カロテン)と酸素を含むキサントフィルに分類される。
本研究の対象であるRsp. rubrum S1株の天然LH1複合体に結合しているカロテノイドの約90%はスピリロキサンチン(N=13)であり、それ以外に少量のアンヒドロロドビブリンやロドビブリンなどのカロテノイドも含まれる。しかしながら、S1株のLH1複合体では、カロテノイドからBchl α へのEET効率はわずか28%に留まることが報告されている[9]。過去の研究により、この低効率の原因として、カロテノイド(スピリロキサンチン)のS2 状態からのみEETが起こり、S1状態からのEETがほとんど生じていないことが示唆されている。一方で、より高いEET効率を示す系では、カロテノイドのS1 状態を利用したEETが効果的に機能していることが分かっている。つまり、S1 状態のEETを活用できるかどうかが、エネルギー伝達の効率を決定する重要な要素であると考えられる。
この点に着目し、私たちは海洋光合成生物の光捕集系に注目した。特に、沖縄モズクやワカメ、コンブなどの海藻類に含まれるフコキサンチン-クロロフィルタンパク質(FCP)に着目した。このFCPに含まれるカロテノイドは、ポリエン骨格にカルボニル基(C=O)を持つフコキサンチンという特殊な分子であり、通常のカロテノイドとは異なる光学的性質を示す。特に、極性環境中では、分子内電荷移動(ICT)励起状態を形成することが知られている。ICT励起状態が存在すると、カロテノイドからBchl α へのEET効率が劇的に向上し、ほぼ100%に達することが報告されている[10]。そこで、私たちはこのフコキサンチンをカロテノイドを持たない光合成細菌のLH1複合体に再構成できるかを検討した。カロテノイドには、アレン基やカルボニル基を持つものもあるが、これは紅色光合成細菌のLHシステムとは根本的に異なるため、こうした複雑な構造を持つカロテノイドが本当にバクテリアに組み込まれるのかが注目され、工夫次第では可能であることがわかった。しかし、蛍光励起分光測定によって決定されたフコキサンチンからBchl α へのEET効率は、わずか28%と低いものであった。そこで、これをさらに詳細に調べるために、フェムト秒時間分解吸収分光法を用いてエネルギー伝達メカニズムを解析した。その結果、フコキサンチンのEET効率が低かった理由は、Bchl α との結合が不適切なものが大部分を占めていたためであり、適切に結合したものでは非常に高いEET効率を示している可能性があることが分かった[11]。そこで、さらなる研究として、私たちは再構成手法を改良し、高等植物由来のカロテノイドであるβ-apo-8'-carotenalを使用した。これはフコキサンチンよりも単純な構造を持ち、なおかつICT励起状態を発現する。このカロテノイドをLH1複合体に取り込むことに成功した。その結果、β-apo-8'-carotenalを結合させたLH1複合体のEET効率は77~79%に達し、従来のカロテノイド結合LH1複合体と比べて顕著な向上を示した[12]。この結果は、カロテノイドのICT励起状態がEET効率向上に重要な役割を果たしていることを示している。以下に、その詳細について解説する。
3 .β-apo-8'-carotenalを再構成した人工のLH1複合体(Reβapo)の光機能
- 図3
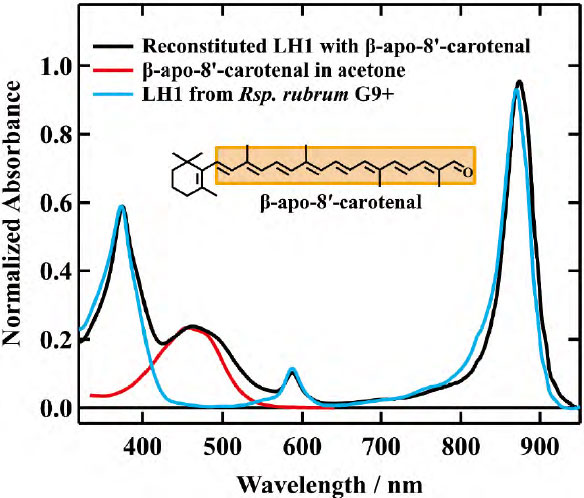
- 再構成したカロテノイドβ-apo-8'-carotenal の化学構造とカロテノイド欠損変異株(Rsp. rubrum G9+株)由来のLH1複合体(青実線)、β-apo-8'-carotenal を再構成したLH1 複合体(黒実線)の吸収スペクトル。
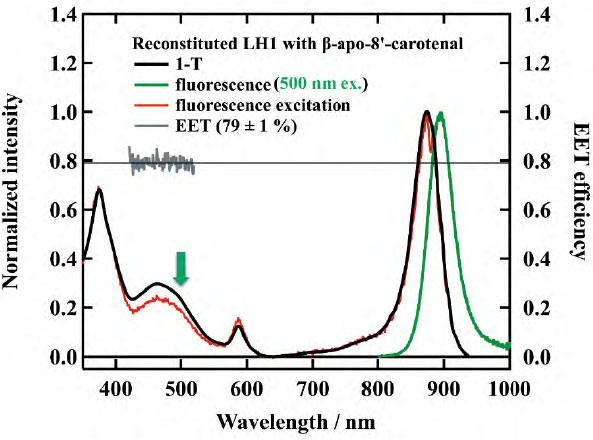
図3に示したのは、カロテノイド欠損変異株(Rsp. rubrum G9+株)由来のLH1複合体(青実線)と、β-apo-8'-carotenalを再構成したLH1複合体(黒実線)の吸収スペクトルである。このスペクトルを見ると、カロテノイドの吸収が400 ~600 nmの領域に現れており、さらにBchl αのQy帯もカロテノイドの影響で長波長側にシフトしている。これにより、β-apo-8'-carotenalがLH1複合体に適切に組み込まれたことが示唆される。EET効率を決定するために、蛍光および蛍光励起分光測定を行った。図4はその結果を示している。カロテノイド領域の吸収と励起スペクトルの強度を比較すると、蛍光励起スペクトルの強度がやや低下していることが分かる。これは、カロテノイドからBchl αへのエネルギー伝達が100%ではなく、一部のエネルギーが失われていることを示している。この領域の吸収と蛍光励起スペクトルの面積比から、EET効率は約80%であることが分かった。つまり、カロテノイドが吸収した光エネルギーの約80%がBchl αに伝達されているということである。
- 図4
- β-apo-8'-carotenal を再構成したLH1 複合体の1-T スペクトル(黒実線)、蛍光スペクトル(緑実線)および蛍光励起スペクトル(赤実線)。1-Tスペクトルならびに蛍光励起スペクトルから算出されるEET効率を灰色の実線で示した。蛍光スペクトル測定時の励起光(500 nm)を緑の矢印で示している。
カロテノイドからBchl α へのEETのダイナミクスを詳細に調査するため、フェムト秒時間分解吸収分光測定を適用した。測定結果の一例として、図5に示される実線の赤線が示すように、アセトン溶液中で励起後0. 50 psに記録されたβ-apo-8'-carotenalのフェムト秒時間分解吸収スペクトルは、530-580 nmのスペクトル領域に比較的鋭い過渡吸収帯を示す。これはS1→Sn 遷移に起因するものと考えられる。さらに、600-700 nmのスペクトル領域には、ICT励起状態に由来する幅広い過渡吸収が観察され、これは先行研究と良好な一致を示す。これらの結果を踏まえ、本研究ではこれらの過渡吸収帯を仮にS1 /ICT状態に割り当てる。同様のS1 /ICT特性を示す過渡吸収スペクトルは、β-apo-8'-carotenalを再構成したLH1複合体(以下、Reβapo)においても観察された。したがって、励起後にReβapo内でICT励起状態が生成されることが明確に示される。さらに、Reβapo中のβ-apo-8'-carotenalのS1 およびICT励起状態に由来する過渡吸収帯の強度比は、アセトン溶液中と類似していた。このことから、Reβapo内でのβ-apo-8'-carotenalの結合部位の環境が、アセトンと同様に極性を有することが示唆される。
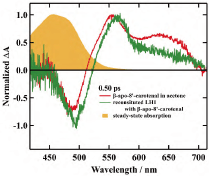
- 図5
- 励起後0.50 ps に記録されたβ-apo-8'-carotenal のアセトン溶液(赤実線)とReβapo(緑実線)のフェムト秒時間分解吸収スペクトル。橙の塗りつぶしはβ-apo-8'-carotenal のアセトン溶液の定常状態吸収を示す。
実際の過渡吸収スペクトルの測定では、励起パルスに対してプローブパルスの到達時間を刻々と変化させながら、多数のスペクトルを記録する。この測定により、励起後の時間変化を詳細に追跡することができる。ただし、測定によって得られるデータは膨大であり、その解析方法が極めて重要になる。このデータの解析をどのように進めるかが、次に取り上げる興味深い課題の一つとなる。
4 .Reβapoにおける励起エネルギー移動
Reβapoの励起状態の緩和とEETプロセスをより深く理解するためには、グローバル解析を、フェムト秒時間分解吸収スペクトルの完全なデータセットを用いて実施する必要がある。まず、アセトン溶液中のβ-apo-8'-carotenalの解析結果を図6に示す。最初の130フェムト秒成分は、S2励起状態からさらに高い励起状態への遷移に対応する吸収として割り当てられる。次に、620フェムト秒成分は、振動的に励起された S1 /ICT 励起状態(hot S1 /ICT 励起状態)に起因すると考えられる。最後に、15.4ピコ秒成分は、完全に緩和した S1 /ICT 励起状態のスペクトルとして解釈される。図6の最下部には、実測データとシミュレーション結果の残差が示されている。この解析では、逐次(sequential)モデルを適用し、S2 →hot S1 /ICT → S1 /ICT という遷移を考慮してフィッティングを行った。その結果、三次元の全データセットが誤差なく再現され、励起状態の時間発展を統一的に解釈できることが確認された。
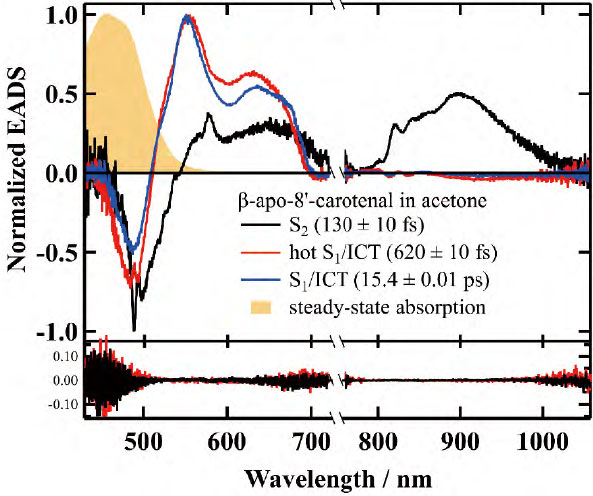
- 図6
- アセトン溶液(赤実線)のフェムト秒時間分解吸収スペクトルの解析結果。Sequentialモデルを適用し、解析した。それぞれのスペクトルの帰属と寿命は図の凡例に示した。また、図の下部にフィッティング残差を示した。
同様の解析をReβapoに適用する場合、状況がやや異なる。アセトン溶液中の解析では、sequentialモデルを適用することで十分であった。しかし、Reβapoでは、S2 状態、hot S1 /ICT状態、および S1 /ICT状態の各段階から、それぞれ

- 図7
- Reβapoのフェムト秒時間分解吸収分光測定の結果を解析するのに用いたparallelモデルの模式図(左)。このモデルにそれに基づいて行った解析より得られた速度定数(k1からk7)を右の表に示した。
B880 Bchl α への励起エネルギー移動が発生する経路が存在するため、単純なsequentialモデルでは解析が困難となる。そのため、逐次的な遷移ではなく、並行(parallel)モデルを構築し、それに基づいて解析を行う必要がある。この解析では、図7に示した7つの速度定数(k1からk7)を適切に決定し、それぞれの状態からの遷移過程を定量的に評価することが求められる。解析を適用した結果、残差がほとんどない精度の高いフィッティングが得られた。図8は、parallelモデルを用いたグローバルフィッティングによって導かれた結果を示している。この解析により、S2 状態、hotS1 /ICT状態、S1 /ICT状態、Bchl α の hot S1 状態(カロテノイドからの励起エネルギー移動後に生成)、およびBchl α の S1 状態という5つの成分が得られた。各成分の寿命は図中の括弧内に±誤差付きで示されており、高い精度で決定されている。
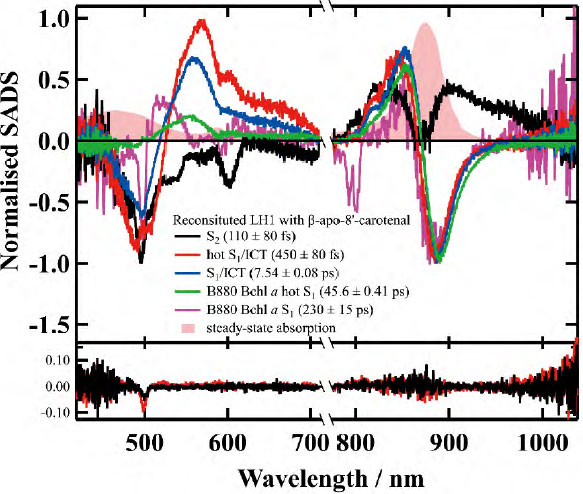
- 図8
- Reβapoのフェムト秒時間分解吸収分光測定の結果を、parallelモデルを用いたグローバルフィッティングによって導かれた結果とそのフィッティング残差(図の下部)。各スペクトルの帰属と寿命は凡例に示した。また、Reβapoの定常状態吸収スペクトルもピンクの塗りつぶしで表示している。
これにより、各励起状態の寿命および励起エネルギー移動の詳細なダイナミクスを定量的に明らかにすることができる。
さらに、決定した速度定数を用いてEET効率を計算すると図9に示した通り、S2 状態からのエネルギー伝達効率は14%、hot S1 /ICT状態からのエネルギー伝達効率は23%、S1 /ICT状態からのエネルギー伝達効率は31. 9%、総合的な励起エネルギー移動効率は70%という結果が得られた。特に興味深い点は、このエネルギー伝達の大部分がICT励起状態を介して行われていることである。紅色光合成細菌Rsp. rubrum S1株の光合成系ではS2 状態からのみ励起エネルギーが移動すると考えられていた。しかし、高等植物由来のβ-apo-8'-carotenalをLH1に再構成することで、S1 /ICT状態を利用した新たなエネルギー伝達経路が可能になった。この結果により、自然の光合成系のエネルギー伝達経路を拡張し、従来の細菌光合成系の効率を上回る光エネルギー変換を実現することに成功したといえる。これは小さな一歩かもしれないが、今後の研究によってより大きな前進へとつながる発見になることが期待される。特に注目すべき点は、今回の成果の鍵となっているのがICT励起状態の関与であるということである。この新たなエネルギー伝達経路の利用が、自然の光合成システムを超える可能性を示唆している。

- 図9
- Reβapoのフェムト秒時間分解吸収分光測定の結果に対して、parallelモデルを用いたグローバルフィッティングを行うことにより得られたエネルギーダイヤグラム。決定した速度定数を用いて計算したEET効率を、各緩和過程の矢印に示している。
5.おわりに
本研究では、カロテノイドの励起状態、特にICT励起状態の機能に新たな視点をもたらす知見を得ることができた。高等植物由来のカロテノイド(β-apo-8'-carotenal)をRsp. rubrum G9+株のLH1複合体に導入することに世界で初めて成功し、再構成LH1複合体においてICT状態からBchl αへのEETが主要な経路となっていることを示した。さらに、ICT状態がカロテノイドからBchl α へのEETにおいて非常に効率的に機能することを実証し、このEETメカニズムが光保護機能も維持していることを明らかにした。これにより、光合成系の効率向上と安定性確保の両立を可能にする新たな戦略を示唆する結果が得られた。以上の成果から、ICT状態の特性を活用することで、人工光合成や光捕集システムの設計に新たなアプローチを提供する可能性が示された。今後の研究課題として、新規カロテノイドの設計、生物種間の比較研究、そして高度な分光技術の導入が挙げられる。これらの取り組みを通じて、カロテノイド研究は、基礎科学としてだけでなく、社会に貢献する応用研究として発展を続けることが期待される。












