バイオイメージング・センシングプラットフォームの開拓
1. はじめに
生体分子や生体組織、あるいは食品・環境物質などの対象物質は、それぞれ多種多様なスケール・濃度で存在している。これら対象物質に対して、 より高性能なイメージングやセンシングを達成するためには、新たな基盤技術開発が必要となる。
産業技術総合研究所 健康医工学研究部門 バイオイメージング研究グループでは、新たなイメージ ング・センシングプラットフォームの開拓に向け、 独自性の高い観察・計測のための装置や材料、ならびに方法論に関する研究開発を進めている。本稿では、各々のトピックについて解説するととも に、最近得られた研究成果を紹介する。
2. 走査電子誘電率顕微鏡の開発と溶液中の生物試料やナノ材料の高分解能観察
水溶液中の生物試料やナノ粒子、有機材料等をナノレベルの分解能で直接観察することは、生物機能の解明やナノ粒子材料の分析に必須である。
これまで、10 nm以下の分解能で試料を直接観察する方法として、電子顕微鏡が主に使用されてきた。しかし、通常の電子顕微鏡では筐体内部が真空となっており、溶液中の生物試料やナノ材料を直接導入し観察することはできない。そのため、試料を溶液のまま封入し、溶液状態を保持したまま観察が可能な大気圧ホルダーが開発されてきた。
だが、この観察方法でも、電子線が直接試料に照射されるため、電子線ダメージが大きく、さらに軽元素で構成される生物試料や有機材料の場合はその比重が水の比重と近いため、コントラストが極めて低いといった問題点がある。
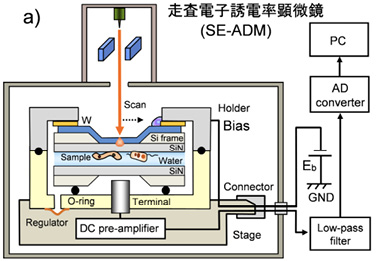
水溶液中のさまざまな試料を電子線により高コントラスト・低ダメージで観察するためには、電子線を試料に直接照射しなければよい。 しかし、電子線をプローブとして使用する限りは、電子線の試料への直接照射が必須となる。我々は、こうした矛盾を解決するため、電子線をタングステン 薄膜に照射・吸収させ、この電位変化を溶液中の試料を透過させて検出し、試料の誘電率の違いを可視化する走査電子誘電率顕微鏡(SE-ADM)の開発を進めてきた1。この方法では、電子線を試料ホルダー上部の窒化シリコン(SiN)薄膜上部タングステン層に照射して吸収させ、薄膜内に局所的な電位変化を生じさせる。この電位変化は、水溶液中の試料を透過し、下側の測定端子により検出される。こうした電位変化の透過率は、物質の比誘電率により規定される。水は比誘電率が80と高いため電位変化を良く透過する一方、生物試料や有機材料は、比誘電率が2~3と低く透過が阻害される1。こうした比誘電率に起因する電位変化の透過状況を可視化することで、電子線ダメージが無く極めて高いコントラストで水溶液中の試料を直接観察することが可能となった(図1a)。
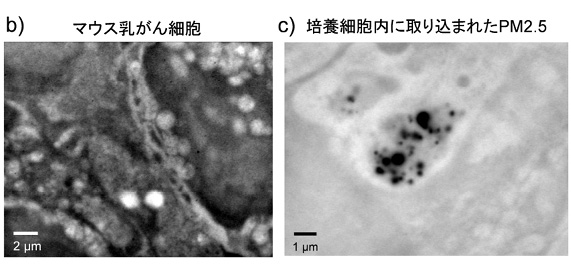
我々はこれまで、SE-ADMを用いて水溶液中のバクテリアや細胞、エマルジョン等のさまざまな溶液中の試料の観察を行ってきた。マウス乳がん細胞の観察では、細胞内の核や内膜構造が極めてコントラスト良く観察可能であった(図1b)2。
さらに、骨を形成する骨芽細胞が分泌する骨形成小胞に関しても細胞内部の形成状態を直接観察する事に成功した3。また、最近では北京の大気より採取されたPM2.5の培養細胞への取り込み状態を直接観察し、細胞内での凝集状態を解析した(図1c)4。
以上のように、我々が開発を進めているSENoADMでは、電子線を試料に直接照射しないため、電子線ダメージを生じず、極めて高いコントラストで細胞の微細構造を直接観察することが可能である。本方法は、生物試料だけでなく水溶液中のナノ粒子の形状や分散状態、さらにはエマルションや油中の改質剤等の観察にも応用が可能である。
3. 目的のタンパク質・コレステロール等を可視化する合成蛍光プローブデザイン
近年、疾患関連物質に関する研究が目覚ましく進歩しており、癌、免疫受容体、受精、発生・分化、感染症、バイオ医薬品開発等において、重要な役 割を果たしていることが明らかとなっている。生体中に存在する疾患関連マーカー物質は極微量にしか存在しないため、新たな評価技術の開発が求 められている。我々は、“バイオセンシング機能を有する新規機能性材料の創製とそれらを利用した高機能光化学センサーの構築”というコンセプトに基づき、特定の生体物質や化学環境に感応して光学特性が鋭敏に変化する機能性材料の研究開発を推進している。
これまでに独自に開発した環境応答性が高い蛍光物質と、標的物質(タンパク質、神経伝達物質等)に対して親和性の高い結合部位を併せ持つさ まざまな機能性材料を開発し、検出感度、選択性、分析操作時間、他分析法との比較の観点から性能評価を行った。
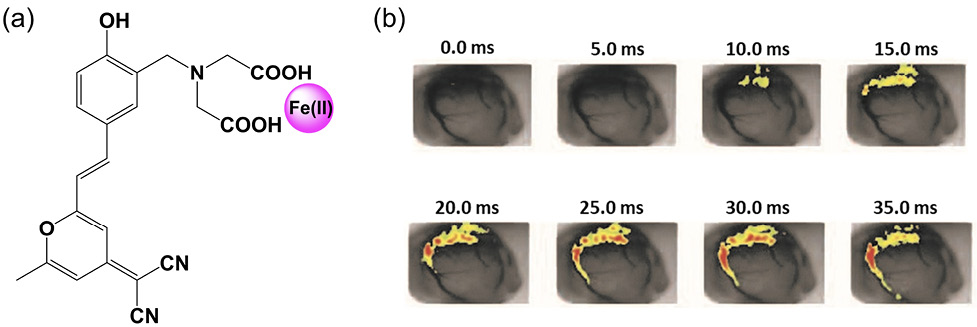
このうち神経伝達物質を選択的に検出するための新規蛍光分子プローブについては、ドーパミンを高感度かつ高選択的に検出するために、ドーパミン認識部位としてイミノ二酢酸と遷移金属イオンから成る錯体と蛍光発色団としてシアノピラニル基を併せ持つ化合物を開発した5。in vitro における評価だけでなく、ラットの脳組織におけるドーパミンのin vivo イメージングを行い、脳組織におけるドーパミンの動的観察を行うことができた(図2)。
さらに、哺乳動物細胞の脂質膜のダイナミック挙動についても評価するためにコレステロールに着目した。コレステロールは脂質膜に必須な成分であり、また情報伝達の調節にも関係している。
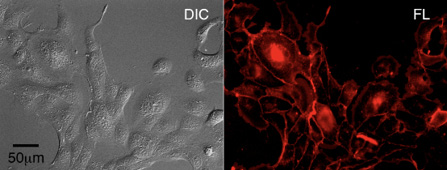
コレステロールの細胞内分布は一様でないため輸送系の存在が推定されるが、その全貌は明らかではない。生きた細胞におけるコレステロールのイメージングは、この輸送系の理解に有益なツールのひとつである。そのためコレステロールに蛍光基を化学的に付加したプローブがこれまで複数開発されたが、コレステロールが局在するはずの形質膜に局在しない等の問題があった。我々は、新たにコレステロールと蛍光基をつなぐ化学構造を工夫した蛍光プローブ(R-Chol)を開発した6。
培地に添加したR-Chol は細胞へ速やかに取り込まれ、その蛍光が形質膜に顕著に観察された(図3)。生化学的分析により、R-Chol はコレステロールと同様に膜マイクロドメインに集まることが示された。
化学センサーが、将来の産業、医療、高齢化社会、環境問題に対応する技術として発展していくためには、新たなる発想に基づく新規機能性材料の開発が不可欠であり、化学物質の単なる化学的特性を利用するだけでなく、複数の分野間の融合から生まれた新素材と組み合わせ、センシング情報を解析するためのより高次のプローブが必要であると考えられる。
4. 蛍光分子の動態計測手法の開発とその応用研究
当研究グループでは、蛍光計測技術に基づく生体分子・微粒子の動態計測技術の開発も進めている。塗料やエマルションのような工業製品の品質管理から、実験室レベルで作成した微粒子の粒子径評価においては、光散乱計測のひとつである動的光散乱法(Dynamic Light Scattering, DLS)がよく用いられる。しかし、散乱光は試料に含まれるすべての分子・粒子から発せられるため、細胞培養上清や細胞溶解液のような測定対象分子以外の分子・粒子を多量に含む生物学的試料の測定には向いていない。一方で、蛍光相関分光法(Fluorescence Correlation Spectroscopy, FCS)では、あらかじめ測定対象分子に蛍光標識を施しておくことで、夾雑物を含む試料においても測定対象分子のみを特異的に測定できる7。また、生きた細胞内においても低損傷でそのまま測定可能である。これらの利点を生かして、FCS は特に生物学分野の研究で用いられるようになってきた。
FCS では回折限界程度まで集光した励起レーザーとピンホールを用いた共焦点蛍光検出系を用いる。図4に点線で示す共焦点領域を蛍光標識した分子・粒子がブラウン運動によってランダムに出入りすることによって、検出される蛍光強度が時間的に変動する。この変動の速さを自己相関解析することにより、測定対象のブラウン運動の速さ、すなわち拡散定数を決定でき、その情報を元に粒子径を決定できる。またFCS では、同時に粒子濃度の情報も得られる。
筆者らは、FCS 技術を基盤とした新たな光ファイバー型FCS 装置の開発を進めている。通常のFCS 装置は上述のように一般的な共焦点蛍光検出系になっており、ピンホール位置の調整は共焦点蛍光顕微鏡観察よりもシビアである。そのため、ピンホール位置の調整を日々行う必要があり、初心者には扱いが難しい装置である。我々が開発した光ファイバー型FCS(Fiber-Optic Based FCS, FB-FCS) は光学系の大部分を光ファイバーに置き換えることで、調整を一切不要なFCS 装置とすることに成功した8。現在はこの装置を用いた生体微粒子の定量・検出に関する研究を進めている。
また、蛍光分子の並進拡散と同時に回転拡散も測定可能なFCS の発展手法である偏光FCS(Polarization dependent FCS, Pol-FCS)装置を用いた基礎研究も進めている。高分子が高濃度で存在している高分子クラウディング溶液中に緑色蛍光タンパク質(GFP)等の蛍光体を導入してPol-FCS 計測を行うと、並進拡散は周囲の高分子によって阻害されるのに対し、回転拡散は阻害されにくいことがわかった。これは蛍光体が回転半径程度の領域からの影響しか受けないことから、高分子の隙間で比較的自由に回転可能であるためと考えられた。このことから、回転拡散と並進拡 散の比較によって、細胞内を含む高分子クラウディング環境中の高分子の間隙広さや環境の混雑レベルの評価が可能であると考えられる。この手法を利用して、生細胞内において細胞質の混雑具合が細胞種や細胞周期に依存して変化している可能性を見出した9。
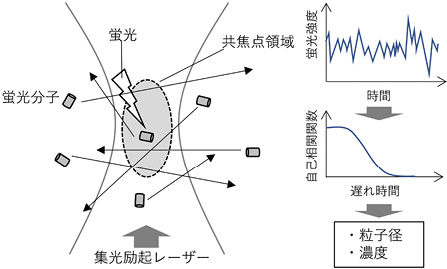
図4 FCS の原理
5. 高感度センシングが可能なナノカー ボン電極材料の創製
電気化学測定法は、分子の酸化還元反応の際に流れる電流や電極界面の電位を測定することで、対象物質を検出する手法である。簡便・安価な検出手法として期待される一方、測定できる電位範囲が狭く微量物質の検出も困難であることから、 測定対象となる物質が限られる点が課題とされてきた。本節では、電気化学法での測定対象の多様化を実現すべく、近年、著者らが開発してきたスパッタ法を用いたナノカーボン薄膜電極について紹介する10。
ナノカーボン薄膜は、スパッタ条件により sp2/sp3結合比の構造制御ができるため、グラファイト並の高い導電性(電極活性)とダイヤモンド並の硬度を併せ持った薄膜特性を有する。実際にナノカーボン薄膜(sp3=40%)電極の電位窓(電極に安定に電位を印加できる範囲)は、市販のグラッシーカーボン(GC、sp3=0%)電極より広く、酸化側でボロンドープダイヤモンド(sp3≒ 100%)電極に準じる広さを有する。また、ナノカーボン薄膜の平均表面粗さは0.1 nmとほぼ原子オーダーで超平坦であるため、電気化学測定時のノイズ電流が極めて低い。
ナノカーボン薄膜電極の広い電位窓と低いノイズ電流の両特性が活かせる測定対象物質としては、化学的に安定(酸化電位が高い)、あるいは存在濃度が極めて低いため電気化学法では検出が困難である物質が該当し、例えば、ゲノム中に極微量含まれる5-hydroxymethylcytosine(5hmC)などの後天的修飾塩基が挙げられる。また、「開発した電極が既存の分析機器とフィッティングできる」ことは産業利用の観点から重要との声を産業界から多くいただいた。
これらの点を実証すべく、5hmCを対象とし、液体クロマトグラフィ(LC)へナノカーボン電極を導入したLC-ECD計測を検討した11。5hmCは、ヒトやマウスの神経組織において存在が確認され、近年神経疾患などの分野においてエピジェ ネティックな因子として注目されている。存在割合は1%以下と低いため、より高感度な5hmC検出技術が必要とされており、これまでにバイサルファイトシークエンシング、抗体、あるいはLC法をベースとした方法などが報告されている。 LC法での課題は、5hmCとその原物質であるシトシン(C)の極性が近いことに加え、5hmCの濃度は極微量であるため、Cとのカラム分離が難しい点である。筆者らは、ナノカーボン電極を用いた電気化学計測により、5hmC、ならびにCはそれぞれ1.62、1.74 V (vs. Ag/AgCl、10 mMリン酸バッファー(pH 4.0)中)で酸化されることを確認した。
この結果から、LC-ECDにおける印加電位を1.6 Vに設定し2種のゲノムDNA(gDNA)試料(酵素処理によりモノヌクレオチド単位まで分解している)を測定したところ、マウス脳由来のgDNAでは、大過剰のCの応答を抑制しながら5hmCの発現を検出できた(検出限界82.5 fmol)(図5)。解析の結果、マウスgDNA試料中の5hmC量は2.2 pmo(l 5hmC化率0.135%に相当)であった。 一方でGC電極では5hmCの検出下限は50 pmolであり実試料中の5hmCを計測できなかったことから、ナノカーボン電極を搭載したLC-ECD計測の優位性を示すことができた。
この他にも、これまで検出が困難であったさまざまな検出対象に合せた電極設計を実現している10。 今後も電極制御に立脚することで測定対象が拡張されていくことが期待される。
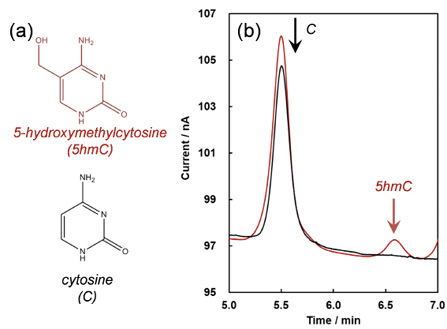
図5 (a)5hmC とC の化学構造、(b)5hmC のLC-ECD 測定。 赤:マウス脳由来gDNA、黒:ウシ胸腺由来gDNA
6.まとめ
本稿では、当研究グループで開発するイメージング・センシング技術ついて解説した。今後、個々の技術の深化と融合により、さまざまな測定対象へ適用可能な付加価値の高い計測プラットフォームへと発展していくことを期待している。
謝辞
本研究の遂行に当たり、村上伸也先生(大阪大学)、金城政孝先生(北海道大学)、丹羽修先生、田中睦生先生(埼玉工業大学)、弊所関係者(岡田知子博士、鎌田智之博士、栗田僚二博士、小島直博士、佐々木章博士、山本慎也博士)をは じめとする多くの共同研究者の皆様に支えていただきました。この場をお借りして厚く御礼申し上げます。本研究の一部は科学技術振興機構 (JST)CREST(JPMJCR19H2)、A-STEP 機能検証フェーズ(JPMJTM19Y0)、科学研究費補助金(19H03230、JP19K06591、JP15K06592)、および埼玉県産学連携研究開発プロジェクトのご支援のもとに実施されました。重ねて御礼申し上げます。












