分析機器・分析化学のやくわりと期待
1. はじめに
分析化学は、対象となるものの性質を明らかにし、その量的関係を知るという科学研究に必須で本質的な部分を支えていることから科学の母とも言われる。例えば環境科学におけるPM2.5をはじめとする大気汚染物質の動態分析や自然・人為起源の揮発性有機化合物の計測、河川水・海水や土壌の分析、医療分野ではMRIやX線による画像診断や臨床化学分析、新規材料の評価や反応メカニズムの解明などあらゆる分野で用いられている。
筆者の所属する化学系の学科において日常行われている時間の大きな部分は分析に費やされているといっても過言ではない。無機化学、有機化学関連の研究室で新規材料解析に用いるNMR、MS、SEM/TEM、XRD等の大型機器、IR、Raman、紫外可視吸光、ICP、AASなどの分光計測、物理化学系研究室が反応解析に用いる電気化学分析や時間分解蛍光分析、環境系ではGC、LC、センサデバイスなどほとんどすべての研究室で分析化学がそのベースを支えている。
科学の進歩は常に起こっているが、発見や発明、特に分析化学的発見・発明により飛躍的に起こると言われる。古くは顕微鏡の発明が細胞の発見につながり、その後の生物学に劇的な進歩をもたらしている。またエネルギーの単位となっているジュールも、精密な温度測定をたよりに現代のエネルギー保存則を実験的に明らかにした。
近年では分析化学に関連する田中耕一氏、下村脩教授がノーベル化学賞を受賞されている。2002年に田中耕一氏は「生体高分子の同定および構造解析のための手法の開発」でジョン・フェン教授(ESIMS)、クルト・ヴュートリッヒ(NMR)とともにノーベル化学賞を受賞された。ソフトイオン化を利用したMSでは、従来のイオン化法では壊れやすかった大型の生体分子のイオン化が可能で、質量分析が可能となった。これにより医学や生物学、特に生化学分野を中心に非常に大きな発展をもたらした。また、分析に必要な試料量が極微量ですみ、試料純度に対する要求性も比較的低いことから高純度な試料を大量に調製することが難しい生体由来の試料の分析を容易なものとした。
一方、下村教授は「緑色蛍光タンパク質の発見と開発」で同様に2008年ノーベル化学賞をマーティン・チャルフィー、ロジャー・チェンと共同受賞されている。カルシウムイオン依存性イクオリンを発見し、その機能を明らかにした。下村教授の発見から30余年を経た1990年代になって別の研究グループがGFP遺伝子の同定・クローニングに成功し、さらにノーベル化学賞の共同受賞者であるチャルフィー、チェンらのグループがトランスジーンとして異種細胞へのGFP導入・発現に成功した。GFPは単体で機能し発色団形成に酵素反応が不要なこと、異種細胞への発現方法が確立したことなどによりレポーター遺伝子として広く普及した。 GFPは細胞生物学・発生生物学・神経細胞生物学などをはじめとして最も広く使われるレポーター遺伝子となっている。
上記の例に示すように新しい分析技術の発見により、それに密接に関連した分野の飛躍進歩が起こっている。しかし、分析技術だけではこのようなことは起こらず、方法の追求のもとになるサイエンスとしての未知・不可能の解決がその価値を決めている。「具体的対象を念頭に置かず方法だけを追求するひとは、多くの場合失敗の憂き目にあう」(ヒルベルト)の言葉にあるように、方法論の追求だけでは大きな波及効果は得られない。 大学の研究者はたいてい科学者であることが多く、企業研究者あるいは一部の大学研究者はテクノロジスト(技術者)を目指している。未知の現象を知りたい、不可能なことを可能にしたいという現代の科学者の切実なニーズを解決する糸口は新しい分析法や装置によってもたらされることが多い。このため科学者と技術者の間のフィードバックループが新たな道を切り開くためにはとても重要なことであると思う。
ちなみに我が国では科学と技術との違いが明瞭でなく、“科学技術”などとして用いられる。科学者は自身の興味に従って研究し、多くの場合専門はもたない狩猟民族的である。科学者が直接世の中の役に立つものの開発に役立てるとは思えないが、得られた成果・知見の積み重ねは科学における大きな池を形成する。この池の中から技術者が世の中に役立ちそうなものを見い出し科学者とともに引っ張り上げることでイノベーションが生まれる。大変残念なことに現在我が国の科学の池は急速に小さくなっており、イノベーションが生じる機会もそれに比例して縮小している。
著者は科学者であるので自分の興味に従って次々と研究を進めている。(関連される先生や学生にとっては迷惑なことかもしれないと知りつつも。)そのため研究内容を変えるたびに初学者となることを何度も経験した。しかしその度に初学者ならではの気づきも多く、自己満足ながらも楽しく研究に取り組むことができた。以下に最近興味をもって進めている研究について概説し、自身のオリジンである分析化学に何を求めるかについて述べる。
筆者はマイクロチップを分離場・反応場として用いる研究に取り組むうち、マイクロ流路内部を部分的に機能化することでさらなる集積化、インテリジェント化が図れると考えていた。その間Y型流路に反応性試薬とその触媒溶液を層流として流すと、その界面で物質合成ができることが報告された。残念ながらこれはマイクロ流路内での反応であるため、任意表面における微小位置選択的な合成はできない。ちょうどそのころ単一細胞分析が注目されはじめ、単一細胞それぞれの違いは何によってもたらされるのか、単一細胞の部分的な操作を行うとこれまでにない何か新しい知見が得られるのではないかと思いつき(単なる思いつきでした)、土日を利用して自身でいろいろな予備実験を行い、先のマイクロ流路内の反応を任意の微小位置選択的に起こすことのできるマイクロ化学ペンの創生に至った。
まず、マイクロ化学ペンの開発とそれによるナノ構造体の位置選択的合成について述べ、次にこの原理を応用した単一細胞操作について述べる。
2. 化学ペンの創生と無機・有機ナノワイヤーの微小位置選択的生成
材料表面の化学的あるいは生化学的な特性を改質し、疎水性・親水性の付与や表面電荷の制御、生体適合性を付与するために多くの方法が考案されている。しかし、表面の微小部位を選択的に化学修飾する手段は少なく、さらに微小位置選択的化学反応により表面改質を行うツールはなかった。材料表面の微小位置選択的な化学修飾・機能化ができれば、分子機械を機能部品とした化学デバイスや、無機・有機ハイブリッド材料を基盤としたマイクロマシンが実現可能である。このような背景のもと、著者らは微小位置選択的な化学反応を実現するため、微小位置選択的化学修飾ツール(化学ペン)を作製した。化学ペンでは2つのノズルの一方から試薬1を、もう一方から試薬2を吐出し、他方のノズルから周囲の溶媒とともに吐出された試薬を吸引することで、試薬1、2の相互拡散領域を形成し、ここで反応を起こし材料表面を位置選択的に化学修飾する。これにより種々の材料表面に銀、高分子、タンパク質などのナノ~マイクロメートル線幅での化学描画を実現1)2)した。
さらなる分解能の向上を目指し、ノズル口径を微小化したナノ描画装置(Nano/Micro Chemical Pen: N/M-CP)を試作した。従来1μm程度であった描画線幅のさらなる微細化をはかった。N/M-CPにより銀、高分子、炭酸カルシウム等の無機・有機ナノワイヤーが位置選択的に形成可能であった。またこれらのナノワイヤーは結晶化して生成することが示唆された。本研究は、無機、有機結晶ナノワイヤーを任意の狙った位置に、狙った大きさで描画した初めての例である。
2-1.化学ペンの作成と化学描画3)4)
ナノメートル線幅の化学描画を実現するため、吐出・吸引ノズルを微細化し、描画条件を最適化した。図1に作製したN/M-CPシステムの外観(a)、試薬流れとそれを利用した化学反応の原理(b,d)、化学修飾する材料表面とマイクロ化学ペンの配置(b,c)、N/M-CPのノズル配置(e)を示した。
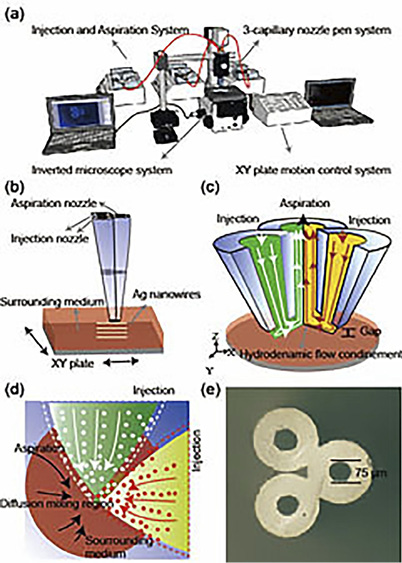
N/M-CPはテーパー状の3本のガラスキャピラリーからなり、隣り合う2本のキャピラリーから反応試薬を吐出し、残りの1本から試薬と溶媒を吸引する。キャピラリー開口部(ノズル)は、溶媒中に沈めた材料表面に近接させ、2本のキャピラリーから反応試薬を吐出するとき、吸引口付近で拡散によりオーバーラップする領域(図1(d))が生じる。この領域は試薬と触媒および試料と反応性試薬が重なる領域で、材料表面で化学反応を位置選択的に起こす。また化学ペンは、材料表面に近接して配置して固定化し、材料を倒立型顕微鏡に備えた微小x, yステージを走査することにより任意の化学反応パターンを得た。
N/M-CPの2本のノズルから反応性試薬を吐出し微小な反応を起こすとき、2つの流れが重なった領域の形状、大きさは位置選択性や分解能に大きく影響する。そこで、材料表面に近接させたマイクロ化学ペン近傍の流れをシミュレーションによって解析した。ノズルから吐出された試薬の流れは、吐出口から吸引口に向かってすぼまるように流れ、吸引口の一点に集中した形状となっている。このとき2つの流れは吸引口付近で一部重なり、この形状は試薬溶液の流れと、試薬分子の拡散によって生じている。また、表面付近の剪断力は吸引ノズルの壁付近で最大となり、管の中央ではほとんど発生しない。吐出側のノズルでも同様で、吐出口壁付近の剪断力が大きいことがわかる。これは細胞などストレスを受けやすい材料を化学修飾する際に重要な指標となる。剪断力の最大値は、吸引流量/吐出流量の比に依存して大きくなった。
種々の口径を持つN/M-CPを用いて、銀ナノワイヤーの微小化学描画を行い、その結果を図2に示す。すなわち、一方のノズルからTollen's試薬を、他方からグルコース溶液を流し、酸化スズで活性化したITO基板に銀ナノワイヤーを析出させた。

ノズル口径の減少とともに線幅が減少し、口径25μmのときに85 nmの最小線幅が得られた。直接描画により100nm以下の線幅を得ることに初めて成功した。これは銀原子約300個が並んだ線幅で、バクテリオファージT4よりも小さい。 線幅はノズルの面積に反比例して減少した。ノズル口径の面積の減少が直接相互拡散領域の大きさを決定するためと考えられる。
次に、無機および有機ナノワイヤーの生成について検討し,結果を図3に示した。まず無機ナノワイヤーとして炭酸カルシウムワイヤーの生成について検討した。ノズルの一方から炭酸ナトリウムを、他方から塩化カルシウムを吐き出し、基板を走査することにより表面に炭酸カルシウムナノワイヤーを生成した(図3(a))。

次に、陽イオン性高分子(HB)と陰イオン性高分子(PSS)を用い、100 nmのナノワイヤーを生成した(図3(b))。N/M-CPによる描画の分解能は、反応性試薬の相互拡散領域の大きさで決定される。相互拡散領域の大きさは、2つの反応性試薬の拡散係数によって決定される。高分子ナノワイヤーの原料試薬であるHBとPSSの拡散係数は銀イオンの10~50倍小さい。拡散領域の大きさは拡散係数の平方根に反比例するので、高分子ナノワイヤーの大きさは銀のそれよりも3~7倍小さく見積もられる。同条件で描画した銀ナノワイヤー(図3(c))の線幅は200 nmであることから考えると、高分子ナノワイヤーの線幅が予想よりも大きかった。これは2つの高分子鎖が、流れに対してランダムに配向することで、計算値よりも鎖の長さ分だけ広がるためと思われる。
以上のように、ガラス基板表面にナノメートル線幅の、無機ナノワイヤー、有機ナノワイヤーを自在に描画することに初めて成功した。
3.プッシュプルノズルシステムによる単一細胞操作
近年細胞を用いた細胞動態、薬物効果測定、代謝産物の研究が活発に行われている。細胞外に放出される物質は微量であるため、通常多数の培養細胞を用いて物質量を増やしたのち測定することが多い。この場合、多数の細胞の平均値が得られる。しかし、同一の培養細胞でも細胞一つひとつで性質が異なることがわかっており、近年単一細胞を用いる方法が活発に研究されている。単一細胞系を構築し種々の操作を行う方法として、液滴を用いて単一細胞を得る方法、微小マイクロウェルに単一細胞を補足する方法などが報告されている。しかし、通常の細胞は周囲の細胞や他の組織と接着して存在しており、遊離細胞を用いる方法はこの点が考慮されておらず、必ずしも正確な評価が得られるとは言えない。
著者らは細胞を平面培養した状態(接着)で種々の単一細胞操作を実現するため、プッシュプル型ノズルシステムを作成し、細胞と壁面との付着力の定量評価5)、細胞の部分的切除、染色6)を初めて実現した。今回は細胞と壁面の付着力評価について述べる。
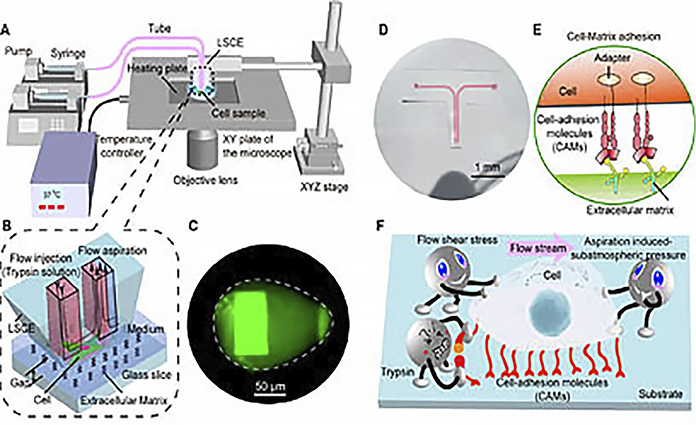
3-1.プッシュプルノズルシステム5)~9)
試作したシステムの概要を図4(文献6から引用)に示す。プッシュプル型ノズルシステムはPDMS製で、50×75 μmの開口径の2つのノズルをもつ。一方のノズルから試薬吐出を、他方から試薬とともに周囲の媒質を吸引した。吐出溶液はトリプシン-EDTA溶液に可視化のため 1μg/mLのフルオレセインを含む培養液を用いた。吸引と吐出流量を適当な値に設定し、プッシュプルノズルを,単一培養細胞を培養したペトリ皿の直上50μmでプッシュプルノズルの間に置いた。
3-2.結果および考察
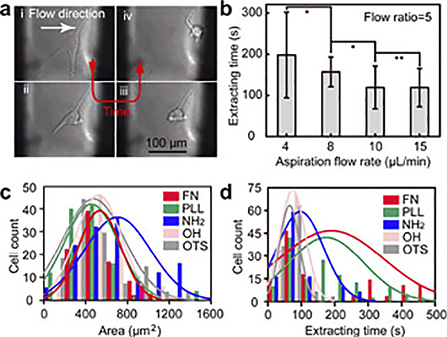
COMSOL Multiphysicsを用いて流体解析を行った。試薬ゾーンは図4(c)に示すような卵型になるが、幅と長さの比は、吸引流量QA吐出流量QIの比Q(QA/QI)が大きくなるに従って小さくなった。今回はシアーストレスと操作性を考慮してQ=5として実験を行った。
次にU87細胞とHepG2細胞を用いて培養細胞1つの抽出を行った。トリプシン溶液をノズルから送液すると、細胞は変形し、その後吸引ノズルに吸い上げられた。個々の細胞が抽出されるまでの時間から細胞の付着力の定量的な評価が可能であった。そこでペトリ皿表面をアミノ基、ポリリジン、オクタデシル基、フィブロネクチンコートし、この上にU87細胞を培養した。これらの基板上の単一細胞を、プッシュプルノズルシステムを用いて抽出し、その結果を図5(文献6から引用)に示した。図5(a)に示すように細胞はトリプシン溶液により経時的に剥離が進行した。 細胞が抽出されるまでの時間は材料表面の官能基に大きく依存し,オクタデシル基<無処理ガラス<アミノ基<ポリリジン基 <フィブロネクチンコートの順となった。
また細胞の付着面積も表面の官能基によって異なることがわかった。著者らの開発したプッシュプルノズルシステムにより細胞の付着力がある程度定量的に評価できることがわかった。
4.機器分析に期待すること
紹介したナノ・マイクロワイヤーの化学的生成、単一細胞操作は他と比較すべき方法がない。ナノワイヤーの描画において、化学ペン先端は溶液中に沈んだ被修飾材料表面直情に位置している。うまく描画できたか否かは、材料を乾燥後FE-SEM、TEM、AFMなどにより観察しているため、研究のスループットが上がらない。溶液中での化学反応を追跡しながらナノワイヤーの生成を観測したいところであるが、そのような方法は現状では見当たらない。また、単一細胞操作においても、顕微鏡で観察できる範囲内での検証は可能であるが、それ以下の分解能で生きた細胞を観測するのは難しい。現在培養組織中の単一細胞毎の分析・操作の研究を始めたいと考えているが、ありのままの細胞を高い分解能で観測できる機器分析の発展に期待したい。
5.謝辞
図の複製をお認めいただいたRoyal Society of ChemistryおよびAmerican Chemical Societyに感謝申し上げます。
参考文献
- 1) S. Mao, C. Sato, Y. Suzuki, J. Yang, H. Zeng, H. Nakajima, M. Yang, J-M Lin and K. Uchiyama, ChemPhysChem, 2017, 18(17), 2357–2363.
- 2) S. Mao, C. Sato, Y. Suzuki, J. Yang, H. Zeng, H. Nakajima, M. Yang, J-M. Lin, and K. Uchiyama, ChemPhysChem, 2016, 17, 3155 – 3159.
- 3) Y. Zhang, S. Mao, Y. Suzuki, Y. Tanaka, M. Kawaguchi, W. Zhang, H. Zeng, H. Nakajima, M. Yang, K. Uchiyama,Chem. Commun., 2018, 54, 719-722.
- 4) H. Lin, S. Mao, H. Zeng, Y. Zhang, M. Kawaguchi, Y.Tanaka, J-M. Lin, K. Uchiyama, Anal. Chem. 91(11), pp.7346-7352.
- 5) S. Mao, W. Zhang, Q. Huang, M. Khan, H. Li, K. Uchiyama, J-M. Lin, Angw. Chem., Int. Ed., 2018, 57, 236-240.
- 6) S. Mao, Q. Zhang, H. Li, Q. Huang, M. Khan, K. Uchiyama, J-M. Lin, Anal. Chem., 2018, 90, 9637-9643.
- 7) S. Mao, Q. Zhang, W. Liu, Q. Huang, M. Khan, W. Zhang, C. Lin, K. Uchiyama, J-M. in, Chemical Science, 2019, 10, 2081-2087.
- 8) S. Mao, Y. Zhang, Q. Zhang, J-M. Lin, K. Uchiyama, Talanta, 187 (2018), 246-251.
- 9) S. Mao, Y. Zhang, H. Li, H. Zeng, J-M. Lin, K. Uchiyama, J. Mater. Chem. C, 2017, 5, 11666-11671.












